En fin d’année dernière, Casma Therapeutics a clôturé une levée de fonds de 46 millions de dollars pour financer sa stratégie de développement de nouveaux traitements innovants contre le cancer, l’inflammation, la neurodégénérescence et les troubles métaboliques en exploitant le potentiel de l’autophagie. La société a nommé le Dr Frank Gentile comme nouveau PDG et utilisera les fonds pour poursuivre ses programmes de recherche sur le lymphome et les tumeurs solides jusqu’à l’obtention de résultats permettant de demander une autorisation d’investigation clinique (IND).
L’autophagie est un processus essentiel de recyclage des composants endommagés d’une cellule pour maintenir sa santé. Cependant, comme de nombreux processus biologiques, l’autophagie subit des altérations liées à l’âge et est impliquée dans de nombreuses maladies liées au vieillissement. Bien que Casma se concentre principalement sur le cancer, la société mène également des recherches sur les maladies inflammatoires et neurodégénératives liées à l’âge. Pour en savoir plus, nous avons interviewé le Dr Keith Dionne, membre du conseil d’administration de Casma et ancien PDG.
Casma a identifié des cibles d’autophagie spécifiques qui peuvent être ciblées pour une dégradation sélective. En ciblant spécifiquement ces cibles de maladies, la société prévoit d’arrêter ou même de renverser la progression de la maladie grâce à ce qu’elle appelle la Dégradation 2.0. Cette approche permet une forme ciblée de dégradation pour traiter des maladies spécifiques.

Casma a validé des cibles d’autophagie définitives qui peuvent être modifiées pour permettre une forme ciblée de dégradation.
« Nous n’avons pas commencé l’entreprise en fonction de la dégradation 2.0, nous avons commencé avec la dégradation 1.0, qui est en fait une induction générale non spécifique de l’autophagie, comme l’effet que vous obtenez du jeûne ou de l’exercice », explique Dionne. « En cours de route, nous avons réalisé que nous pouvions potentiellement utiliser l’autophagie pour dégrader des cibles de maladies spécifiques qui sont indégradables par le système protéasome. Personne n’a jamais été capable de le faire auparavant. »
Dégradation ciblée ou spécifique
Dionne explique que ce changement a été motivé par des découvertes scientifiques démontrant que l’autophagie est un « système de dégradation ciblée. »
Le seul système dans le corps qui peut dégrader de nombreuses plaques moléculaires, comme les plaques d’Alzheimer, est le système d’autophagie
Dr Keith Dionne, membre du conseil d’administration de Casma et ancien PDG.
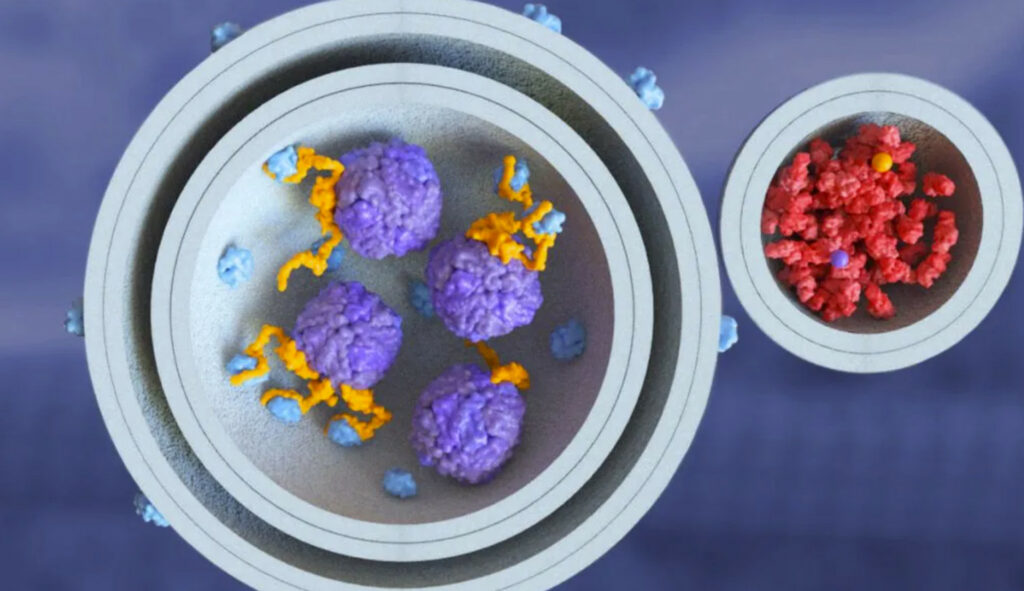
« En d’autres termes, c’est la présence de la cible de la maladie elle-même lorsqu’elle entre en contact avec l’un des principaux moteurs moléculaires de l’autophagie qui entraîne la formation d’un autophagosome autour de cette cible de maladie spécifique », dit-il. « Cela nous a amenés à poursuivre l’objectif de conduire la formation d’un autophagosome autour de cibles de maladies spécifiques que nous voulons dégrader, au lieu de simplement induire plus d’autophagosomes et d’espérer qu’ils dégraderont également certaines des choses dont nous voulons nous débarrasser. »
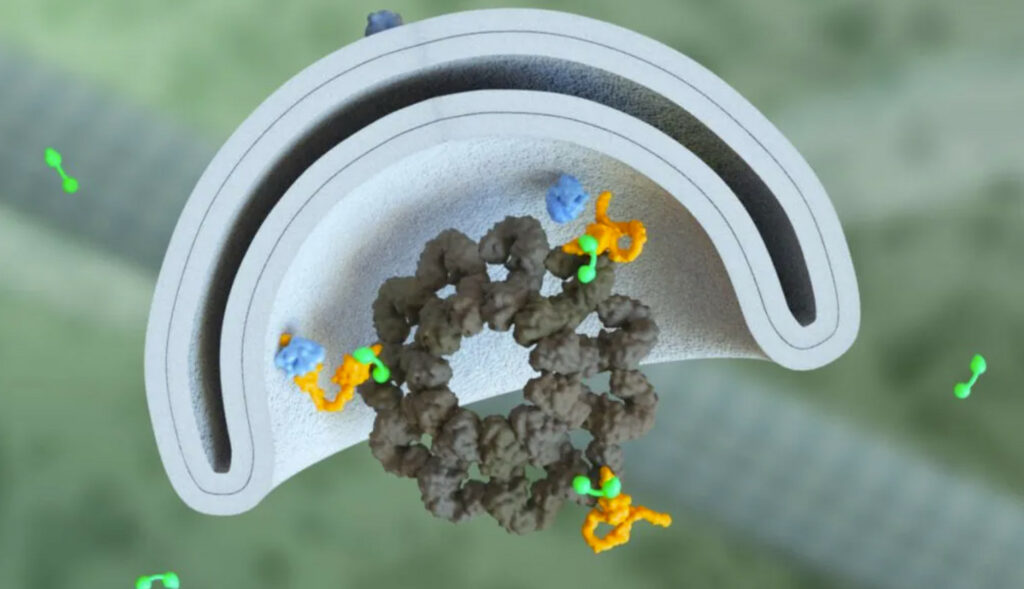
L’autophagie devient altérée avec l’âge et est impliquée dans de nombreuses maladies liées à l’âge.
Ces découvertes ont inspiré le concept de Dégradation 2.0 et ont mené Casma à développer sa plateforme technologique, nommée PHLYT.
« PHLYT est une molécule bifonctionnelle dont l’un des côtés se lie à l’une des deux protéines moléculaires clés impliquées dans la formation des autophagosomes », explique Dionne. « De l’autre côté, il y a n’importe quel type de liant, une petite molécule par exemple, quelle que soit la cible d’intérêt de la maladie que nous voulons dégrader. »
Lorsque ces deux parties sont combinées, Casma a remarqué que des événements se produisent qui ne se seraient pas produits si elles avaient été séparées.
« Amener la protéine d’autophagie appropriée à proximité de la cible de la maladie initie la formation d’un autophagosome autour de cette cible de la maladie », dit-il. « Ce qui signifie qu’il détient un potentiel bien au-delà de l’induction générale de l’autophagie. En fait, nous pensons pouvoir prendre des molécules prêtes à l’emploi qui ont déjà été optimisées pour une cible de maladie particulière d’intérêt et les utiliser du côté liant. Une fois que vous combinez notre côté propriétaire de la molécule avec l’une de ces molécules ciblant la maladie, elles deviennent une nouvelle molécule PHLYT bifonctionnelle qui nous donne un point de départ très solide à partir duquel optimiser ses propriétés. »
Lien entre l’autophagie et la neurodégénérescence
Bien que les programmes les plus développés de Casma se concentrent sur l’oncologie, Dionne souligne que l’approche de l’entreprise a le potentiel de traiter de nombreuses autres maladies, comme la neurodégénérescence.
« Le seul système dans le corps qui peut dégrader de nombreuses plaques moléculaires, comme les plaques d’Alzheimer, est le système d’autophagie », dit-il. L’autophagie, étant plus grande que le protéasome, a la capacité de dégrader des cibles de maladies plus larges et complexes telles que les organites, les agrégats de protéines et les grands complexes de signalisation. Contrairement au protéasome, qui ne peut pas dégrader ces cibles, la plupart, voire la totalité, des cibles de la maladie liée à la neurodégénérescence sont des complexes multiprotéiques de grande taille qui sont simplement trop volumineux pour être dégradés par le protéasome.
Selon Dionne, Casma a discuté avec plusieurs partenaires potentiels de l’industrie pharmaceutique, et la plupart ont montré leur intérêt à collaborer avec l’entreprise dans le domaine de la neurodégénérescence. Alors, pourquoi l’entreprise a-t-elle décidé de se concentrer en premier lieu sur l’oncologie ?
« Les maladies neurodégénératives sont difficiles et coûteuses, il faut plusieurs centaines de millions de dollars pour mener un essai de phase 3 sur la maladie d’Alzheimer,
c’est donc un domaine difficile à démarrer pour une petite entreprise de biotechnologie », explique Dionne. Nous avons pris la décision de commencer par des cibles de maladies périphériques dans l’oncologie car passer des molécules bifonctionnelles à travers la barrière hémato-encéphalique est une tâche difficile nécessitant une optimisation significative. En commençant par ces cibles périphériques, nous pouvons non seulement développer notre plateforme, mais aussi progresser les molécules vers la clinique et les mettre sur le marché de manière rentable et en moins de temps. Les cibles périphériques ne nécessitent pas autant d’optimisation que celles dans la neurodégénérescence. Comme l’a expliqué Dionne, « faire passer des molécules bifonctionnelles à travers la barrière hémato-encéphalique n’est pas la chose la plus facile à faire et peut nécessiter une optimisation significative ».
Les avancées dans le domaine du cancer ont catalysé d’autres programmes
Casma devrait pouvoir poursuivre l’ensemble de ses travaux précliniques sur les lymphomes et les tumeurs solides avec le nouveau financement, y compris la démonstration de l’efficacité in vivo de sa plateforme pour la dégradation de cibles de maladies complexes. La plateforme de Casma est bifonctionnelle, ce qui signifie que l’entreprise travaille également sur des conditions telles que la neurodégénérescence, bien qu’indirectement.
« Nous travaillons simultanément sur plusieurs indications, car la percée clé se situe du côté de la machinerie d’autophagie de la molécule », explique Dionne. « Nous pensons que les protéines induisant l’autophagie cibles que nous avons identifiées peuvent être des dégradateurs universels qui peuvent entraîner une dégradation dans un contexte oncologique ou neurodégénératif. Ainsi, en développant des dégradateurs pour l’oncologie, nous faisons également l’essentiel du travail pour développer des dégradateurs pour d’autres indications comme la neurodégénérescence. »
« Par exemple, il n’est pas si difficile de changer ensuite le côté liant cible de la molécule bifonctionnelle pour cibler des enchevêtrements de protéine huntingtine mutée comme on le trouve dans la maladie de Huntington. Donc, indirectement, nous travaillons sur plusieurs domaines thérapeutiques, c’est juste en ce moment que notre objectif immédiat est l’oncologie. »
Le laboratoire de Skinner a mené une analyse des cellules dans les échantillons de joues prélevés chez des jumeaux discordants, révélant des différences épigénétiques. Dans la paire discordante, le jumeau avec une activité physique élevée (définie comme plus de 150 minutes d’exercice par semaine) présentait des altérations épigénétiques dans les régions de méthylation de l’ADN qui étaient corrélées à un indice de masse corporelle et à un tour de taille réduits. Ces régions sont liées à plus de cinquante gènes spécifiques à l’activité physique intense et aux facteurs de risque métaboliques. Bien que la plate-forme bifonctionnelle de Casma soit axée sur le cancer, elle travaille également indirectement sur la neurodégénérescence et d’autres conditions.
Selon Skinner, la communauté scientifique a observé que la plupart des jumeaux identiques développent des maladies différentes en vieillissant, malgré le partage des mêmes gènes. Il a ajouté que l’épigénétique pourrait aider à expliquer cette observation.
« Si la génétique et la séquence d’ADN étaient le seul moteur de la biologie, alors essentiellement les jumeaux devraient avoir les mêmes maladies. Mais ce n’est pas le cas », a déclaré Skinner. « Cela signifie donc qu’il doit y avoir un impact environnemental sur les jumeaux qui est à l’origine du développement de la maladie. »
SOURCE : Longevity.Technology
Traduit de l’anglais