
Les cellules de notre organisme, tout comme notre planète, consomment des ressources et produisent des déchets. Pour optimiser cette gestion des déchets, il est essentiel de réutiliser autant que possible. À l’échelle cellulaire, cette régulation des déchets est assurée par l’autophagie, un processus naturel de recyclage. L’autophagie permet la décomposition des composants inutiles ou endommagés au sein d’une cellule, afin de les réutiliser comme matériaux de base pour la régénération cellulaire ou la formation de nouvelles cellules. Lorsque ce processus est perturbé, des dysfonctionnements peuvent survenir, à l’instar de ce qui peut se produire à l’échelle planétaire.

Se passer de nourriture de temps en temps peut induire une autophagie.
L’autophagie contribue de manière significative à la préservation de la santé cellulaire. Elle se manifeste souvent pendant le sommeil ou lors de périodes de jeûne de courte durée, et peut également être induite par la prise de certains médicaments.
Les différentes étapes de l’autophagie, ses bénéfices ainsi que les conséquences d’un dysfonctionnement de ce processus sont présentés dans cet article. L’autophagie impacte significativement l’environnement intra et extra-cellulaire.
Voici quelques-uns des avantages que peut apporter l’autophagie au niveau cellulaire :
- Réduire le stress oxydatif, qui peut nuire au corps en endommageant les cellules via des molécules instables (radicaux libres)
- Maintenir la stabilité des gènes
- Favoriser la conversion efficace des nutriments en énergie
- Augmenter l’élimination des déchets cellulaires
En dehors de la cellule, l’autophagie peut également offrir les avantages suivants :
- Réduire l’inflammation
- Rétablir l’équilibre du système neuroendocrinien, qui implique des substances hormonales régulant l’activité nerveuse
- Soutenir la détection des cellules cancéreuses par le système immunitaire
- Accroître l’élimination des cellules vieillissantes.
Il est largement admis que la capacité des cellules à se décomposer en parties par autophagie diminue avec l’âge, contribuant ainsi au processus de vieillissement.
Nous pouvons penser à l’autophagie comme un programme de recyclage naturel de notre corps
Comment fonctionne l’autophagie ?
Pendant l’autophagie, le cytoplasme de la cellule ainsi que ses organites (les petites structures cellulaires ayant des fonctions spécifiques) sont dégradés et recyclés. Ce processus permet de maintenir l’homéostasie du corps en éliminant les parties des cellules qui ne fonctionnent plus correctement.
L’autophagie est souvent initiée par la privation de nutriments à la cellule. Ce processus implique l’action de l’insuline et du glucagon, deux hormones produites par le pancréas qui jouent un rôle clé dans la régulation de la glycémie.
Après un repas, l’organisme produit de l’insuline tandis qu’en cas de jeûne, c’est le glucagon qui est libéré lorsque la glycémie commence à baisser. Le glucagon indique alors au corps d’utiliser le glycogène stocké dans le foie pour augmenter la glycémie. Des études suggèrent que l’insuline inhibe l’autophagie, tandis que le glucagon peut activer ce processus.
Les cycles d’autophagie
Les étapes de l’autophagie se composent de quatre phases distinctes : la séquestration, le transport, la dégradation et l’utilisation.
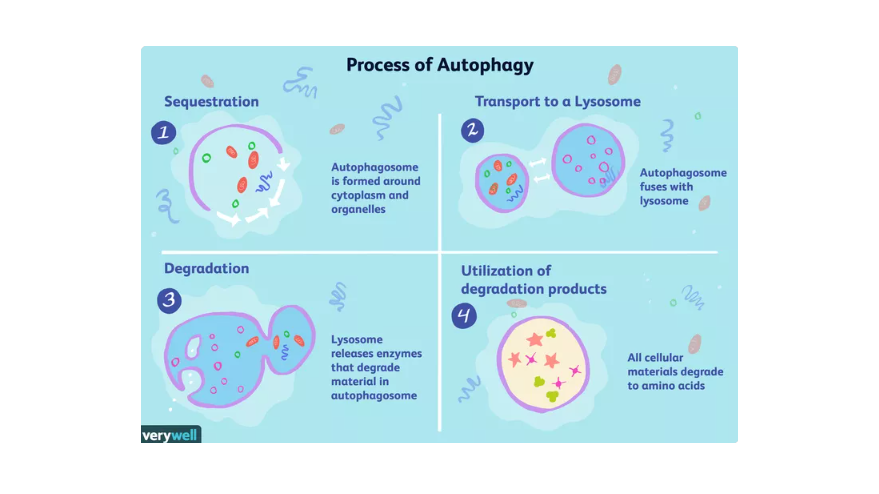
Les processus d’autophagie sont tous importants pour maintenir l’équilibre.
Chacune de ces phases est cruciale pour maintenir l’équilibre cellulaire et peut être sollicitée à tout moment pour répondre aux besoins de l’organisme.
Séquestration
Lors de cette phase, deux membranes connues sous le nom de phagophores se déploient pour encapsuler des parties du cytoplasme et des organites qui seront ultérieurement dégradés. Cette double membrane évolue en une organelle nommé autophagosome.
En général, les éléments qui se retrouvent à l’intérieur d’un autophagosome sont choisis simplement parce qu’ils se trouvent à proximité. Toutefois, les autophagosomes peuvent faire preuve de sélectivité et amorcer le processus d’autophagie en réponse à l’interaction avec certaines protéines spécifiques présentes dans la cellule.
Transport
Le lysosome est un organite de forme sacculaire qui renferme des enzymes, des protéines capables de déclencher divers processus biologiques. Ces derniers peuvent être mobilisés dans le cadre du processus de dégradation. Les autophagosomes, quant à eux, ne peuvent pas directement fusionner avec un lysosome. Ils s’associent alors préalablement à une structure intermédiaire connue sous le nom d’endosome. La fusion de ces deux entités donne naissance à un nouvel organite, l’amphisome, qui peut aisément fusionner avec un lysosome.
Détérioration
La défaillance, également appelée dégradation, peut survenir après la fusion des organites. Lorsque l’amphisome se connecte au lysosome, ce dernier libère des enzymes nommées hydrolases. Ces hydrolases procèdent à la dégradation des éléments qui étaient contenus dans l’autophagosome d’origine. Le résultat final est un organe appelé autolysosome ou autophagolysosome, rempli de matière cellulaire décomposée, incluant des acides aminés.
Utilisation
Une fois évacués hors de l’autolysosome et dans le liquide intracellulaire, les acides aminés sont disponibles pour une réutilisation ultérieure. Cette étape est en corrélation avec la carence en nutriments à l’intérieur de la cellule. Les acides aminés dégradés sont finalement essentiels pour la gluconéogenèse, un processus biochimique qui permet à l’organisme de produire du glucose, ou du sucre, à partir de sources non-glucidiques.
Les acides aminés peuvent être utilisés comme source d’énergie dans le cycle de Krebs, également connu sous le nom de cycle de l’acide tricarboxylique (TCA), lorsqu’ils sont recyclés pour produire de nouvelles protéines.
Les catégories
Jusqu’à présent, cet article a exposé la macroautophagie comme étant le type d’autophagie principal. Il est important de noter que les termes « autophagie » et « macroautophagie » sont interchangeables et peuvent être utilisés l’un pour l’autre.
Il existe également deux autres types d’autophagie :
- La microautophagie est un processus similaire à la macroautophagie, à la différence qu’elle n’utilise pas de phagophore. Au lieu de cela, le lysosome attire directement le contenu cellulaire, qui est ensuite décomposé en acides aminés pour être réutilisé.
- L’autophagie médiée par chaperon est une méthode plus spécifique de ciblage des protéines à dégrader. Les protéines chaperonnes s’associent à d’autres protéines pour les aider à se replier correctement en une forme tridimensionnelle, nécessaire à leur fonctionnement. En plus de cela, les protéines chaperonnes collectent ces protéines et les acheminent à travers la membrane du lysosome pour qu’elles soient dégradées en acides aminés, pouvant ainsi être réutilisés.
Signification
L’autophagie présente de nombreux avantages pour la santé, ce qui a suscité un intérêt croissant pour les moyens de stimuler ce processus.
En effet, des recherches sont en cours pour identifier des méthodes permettant d’activer l’autophagie, notamment pour lutter contre les troubles neurodégénératifs qui endommagent les cellules et les connexions du système nerveux, ainsi que pour réguler l’autophagie chez les personnes atteintes de cancer.
De plus, l’autophagie suscite de l’intérêt pour ses potentielles propriétés anti-âge et ses effets métaboliques accrus, notamment la dégradation et l’utilisation des aliments comme source d’énergie.
Les traitements pour les troubles neurodégénératifs
Les possibilités d’utiliser l’autophagie pour traiter des maladies sont prometteuses. Les chercheurs travaillent actuellement à identifier des médicaments capables d’activer ou de désactiver sélectivement l’autophagie.
Des médicaments sont en cours d’étude pour voir s’ils peuvent stimuler l’autophagie chez les personnes atteintes de certaines maladies neurodégénératives, qui sont liées à des dysfonctionnements de l’autophagie à des niveaux génétiques telles que :
- La maladie de Huntington
- Les maladies d’Alzheimer et de Parkinson
- La Sclérose latérale amyotrophique (SLA)
Traitement du cancer
Le cancer est également associé à une autophagie anormale, mais cette relation n’est pas liée aux gènes. En effet, l’autophagie a des propriétés de protection cellulaire qui visent à prévenir la formation de cancers. Cependant, une fois qu’une tumeur s’est développée, l’autophagie peut contribuer à empêcher la tumeur d’être détruite par les processus de lutte contre le cancer normaux du corps.
Des traitements contre le cancer sont actuellement à l’étude pour inhiber l’autophagie en ciblant la partie lysosomale du processus.
Jeûne
Une méthode pour induire l’autophagie consiste à pratiquer le jeûne intermittent ou prolongé, en épuisant les nutriments cellulaires. Dans ces conditions, l’autophagie est déclenchée pour produire des acides aminés qui peuvent être utilisés comme source d’énergie pour maintenir la fonction cellulaire.
Les études portant sur les effets du jeûne sont pour la plupart limitées aux expérimentations sur les animaux, ce qui rend difficile de savoir quelles sont les durées et les fréquences de jeûne qui peuvent être bénéfiques ou nuisibles chez les êtres humains. En outre, il n’est pas encore clair si le jeûne peut réellement aider à prolonger la durée de vie ou à prévenir et traiter certaines conditions.
Les études sur les animaux ont montré que le jeûne peut compléter les traitements contre le cancer, tels que la chimiothérapie, en protégeant les cellules saines et en améliorant potentiellement l’efficacité du traitement. Cependant, il est nécessaire de mener des études pour déterminer si ces résultats sont également applicables à l’homme.
Jusqu’à présent, les études préliminaires indiquent que le jeûne à court terme pendant le traitement de chimiothérapie est généralement sûr pour les personnes, bien que cela puisse être difficile. En plus du jeûne, les régimes à faible teneur en glucides peuvent également être utilisés pour induire l’autophagie en privant le corps de sucres facilement accessibles. Cette privation stimule la production d’acides aminés qui peuvent ensuite être utilisés pour fournir de l’énergie via la gluconéogenèse et le cycle de l’acide citrique, car les glucides ne sont pas facilement disponibles.
En conclusion
On peut considérer que l’autophagie est un processus vital qui contribue à maintenir un équilibre sain des cellules de votre corps en éliminant les composants endommagés ou vieillis et en les recyclant. Ce processus permet la production d’acides aminés qui peuvent être utilisés comme source d’énergie ou pour la synthèse de nouvelles protéines.
Certaines maladies neurodégénératives qui affectent le système nerveux et ses connexions sont liées génétiquement à un dysfonctionnement de l’autophagie. L’autophagie est bénéfique pour protéger contre le cancer, mais une fois qu’une tumeur est établie, elle peut réellement protéger les cellules cancéreuses dans certains cas.
Les scientifiques explorent les différentes options pour cibler l’autophagie à travers des médicaments ou des changements de mode de vie, tels que le jeûne, afin de développer des traitements de soutien.
SOURCE : verywell health
Traduit de l’anglais









